14 Nov CAPITULO 2 – TEMPERATURA Y TERMODINÁMICA
Como ya se ha expuesto en el anterior capítulo, la temperatura es una magnitud termodinámica, y por eso este Capítulo tiene por objeto proporcionar al lector aquellos conceptos fundamentales de la Termodinámica que le faciliten la comprensión de los fenómenos, ideas y leguaje utilizado en posteriores capítulos.
Termodinámica y energía
La Termodinámica es la ciencia de la energía. Existen diversas formas de manifestarse la energía y el calor es una de ellas. La palabra Termodinámica proviene de los vocablos griegos “thermos” (calor) y “dynamis” (potencia). Así pues, se puede considerar a la Termodinámica como la ciencia que estudia la forma de realizar un trabajo a partir del calor.
Desde los sistemas de aire acondicionado, hasta la generación de electricidad, pasando por la industria química, farmacéutica, cementera, transporte, espacial, etc., en la mayor parte de las actividades industriales se produce una interacción entre energía y materia, y por lo tanto tienen lugar procesos termodinámicos.
El Primer Principio de la Energía establece que durante una interacción entre substancias, la energía puede cambiar de forma de manifestarse, pero la suma de todos los tipos de energía permanece constante. Dicho de forma abreviada “la energía ni se crea ni se destruye, solo se transforma”. Por ejemplo, el ser humano adquiere energía por medio de la alimentación, y la cede realizando ejercicio físico o vital, el balance energético de este proceso produce como resultado el aumento o la pérdida de peso.
Sistema termodinámico
En Termodinámica sistema, puede ser una cantidad de materia o una región del espacio elegida para su estudio, ver figura 2-1. La región situada fuera del sistema recibe el nombre de alrededores.
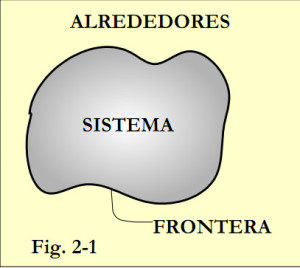
La separación entre sistema y alrededores se llama frontera. Según sea el sistema, la frontera puede ser fija o móvil. Conviene tener en cuenta que la frontera es la superficie de contacto compartida por sistema y alrededores. Matemáticamente, el espesor de la frontera es cero, no contiene masa y no ocupa volumen. Con frecuencia los sistemas termodinámicos son modelos imaginarios.
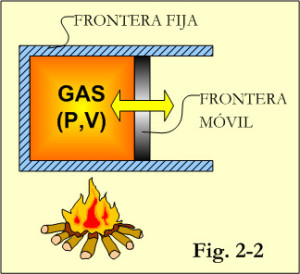
Los sistemas pueden ser cerrados o abiertos, dependiendo de si se elige trabajar con una masa fija o un volumen fijo. Un sistema cerrado consiste en una masa fija que no puede cruzar la frontera, aunque la energía en forma de calor o trabajo si puede cruzarla. Si tampoco se permite que la energía cruce la frontera, el sistema cerrado se convierte en un sistema aislado. Los sistemas cerrados suelen tener alguna parte de su frontera móvil, ver figura 2-2.
Un sistema abierto, también llamado volumen de control, es una región seleccionada del espacio. Normalmente encierra a un dispositivo que comprende un flujo de masa, por ejemplo, un compresor, una turbina o una tobera.
Es importante determinar el tipo de sistema, pues las relaciones termodinámicas son diferentes en los sistemas cerrados y abiertos.
Efecto externo
Un efecto externo es algo que cruza la frontera del sistema, alterándolo. Con frecuencia se trata de energía en forma del calor o trabajo. Puede ser una presión externa, un campo magnético, calor, fuerzas gravitatorias, etc. La frontera de un volumen de control (también llamada superficie de control) puede ser cruzada por la masa o la energía. El caso más común de un volumen de control es el calentador de agua.
Propiedades internas
A las características de una sustancia contenida dentro de un sistema se le denominan propiedades internas. Dicho de otra forma, propiedades internas son las de los materiales contenidos en el sistema. Muchas de ellas son propiedades de estado y matemáticamente son diferenciales exactos.
Propiedades de estado
Son aquellas que pueden ser utilizadas para describir el estado de un sistema sin ambigüedades o con la menor incertidumbre posible. Se trata de propiedades internas, es decir propiedades del material, no de los efectos externos. Son siempre diferenciales exactos y frecuentemente son utilizados en una ecuación de estado.
Gas perfecto
Un gas perfecto es un gas ideal que obedece la ley de los gases perfectos, PV=nRT. Los gases monoatómicos cuando se encuentran a muy baja presión cumplen con cierta aproximación esta ley.
Formas de energía
La energía puede transferirse mediante varios tipos de transformación, entre las cuales se puede mencionar: térmica, mecánica, cinética, potencial, eléctrica, magnética, química, nuclear, etc. La suma de todas ellas constituye la energía total E, de un sistema.
Para estudiar la temperatura no es necesario conocer la energía total del sistema, normalmente interesa conocer el cambio de energía total. De modo que tiene sentido cuando a veces se habla de energía cero de un sistema, porque se trabaja en términos relativos.
Energía interna
Comprende todas las formas de energía que existen dentro de un cuerpo, se suele designar con la letra U. La energía interna de un sistema, esta formada por dos componentes, macroscópica y microscópica. El primer caso corresponde a la energía que el sistema posee en relación con una referencia exterior, por ejemplo, la energía cinética y potencial. El segundo componente (microscópica) esta relacionado con la estructura molecular del sistema y su grado de actividad, sin referencia a ningún sistema exterior.
Examinando un sistema a nivel molecular, se observa que cada molécula se mueve con una cierta velocidad, vibrando al tiempo que rotan sobre un eje de una manera aleatoria. Asociadas a estos movimientos se encuentran diversos tipos de energía cinética, de traslación, vibratoria, y de rotación, cuya suma constituye la energía cinética de la molécula. A la porción de energía interna de un sistema asociada con la energía cinética molecular se le denomina energía sensible. En los gases, la velocidad promedio y el grado de actividad molecular es proporcional a su temperatura, es decir que cuanto más alta sea la temperatura, mayor cantidad de energía cinética poseerán las moléculas y por tanto, la energía contenida en el sistema será mayor.
La energía interna también se asocia con las fuerzas intermoleculares, que son muy intensas en los sólidos, menos en los líquidos y mucho menos en los gases. Aportando suficiente cantidad de energía a una sustancia sólida, pueden vencerse las fuerzas intermoleculares, de modo que las moléculas comienzan a alejarse y es posible conseguir un cambio de fase. De ello se puede concluir que un sistema en fase gaseosa se encuentra en un nivel energético superior al de la fase líquida o sólida. La energía interna asociada a la fase de un sistema recibe el nombre de energía latente.
Todos los cambios descritos, tienen lugar sin modificación de la composición química. A veces una interacción entre sistemas puede provocar alteraciones en los enlaces atómicos, convirtiendo una sustancia en otra. Esta conversión puede realizarse con liberación o absorción de energía. A la energía interna asociada con los enlaces atómicos se la denomina energía química o de enlace.
También en el átomo existen unas fuerzas de enlace que determinan su composición. Estas fuerzas existen tanto en el núcleo como en su corteza (electrones). A la energía relacionada con estas fuerzas, se la denomina energía nuclear. Cuando algunos núcleos muy grandes se escinden para formar otros más ligeros (fisión nuclear), la suma de las energías necesarias para retener las partículas de los núcleos resultantes suele ser inferior a la del núcleo inicial, liberándose el exceso de energía.
Todas las formas de energía descritas forman parte de la energía total de un sistema y pueden ser almacenadas en él, constituyendo lo que se denominan formas estáticas de energía. Cualquier otro tipo de energía que no pueda ser almacenado en el sistema se considerará como energía dinámica. Su característica más importante en relación con el sistema objeto de estudio, es que cruza su frontera, y representan la energía ganada o perdida por el sistema durante un proceso. Es el caso de las transferencias de calor y el trabajo.
Los sistemas abiertos también intercambian energía por medio de la transferencia de masa, puesto que esta contiene energía.
Calor
Vulgarmente se define calor a una forma sensible y latente de la energía interna, considerándose como el contenido calorífico de los cuerpos. Para la termodinámica esas formas de energía se conocen como energía térmica.
A efectos de análisis de temperatura podemos decir que calor es la energía térmica transferida durante el proceso, o que cruza la frontera del sistema. Se mide en Joule (J) y no es un diferencial exacto.
Trabajo
El trabajo es la energía mecánica que atraviesa la frontera del sistema, o se transfiere de un lugar a otro dentro del sistema.
Entalpía
La definición de esta propiedad se debe a Richard Mollier, que atribuyó gran importancia al contenido de calor o calor total de un cuerpo, expresado por la suma de la energía interna, U, y P·V. Como estas expresiones presentaban dificultades de terminología, en los años treinta fueron sustituidas por el termino entalpía, (del griego enthalpien, que significa calentar).
La entalpía es un característica importante de un sistema, y viene dada por la expresión:
H = U + PV
Es importante, porque en muchos sistemas gaseosos no tienen lugar cambios de energía cinética o potencial cuando están sometidos a presión constante. En tales sistemas, los cambios producidos por la presión externa afectan simultáneamente a energía interna y trabajo. La entalpía puede ser definida en un punto de un sistema y es un diferencial exacto.
Calor específico
El calor específico es la energía requerida para incrementar en 1ºC la temperatura de la unidad de masa de una sustancia. Puede ser medido a volumen o temperatura constante. El calor específico a presión constante es mayor que a volumen constante, porque deberá vencerse la presión exterior a causa de la expansión térmica positiva (generalmente los materiales se expanden con la temperatura).
Matemáticamente se define así:
calor específico a volumen constante,
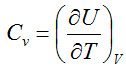
calor específico a presión constante,
Proceso isotermo
Es el que se realiza sin modificación de temperatura.
Medio isotermo
Es el que tiene una distribución de temperatura homogénea. Si se refiere a un sistema isotermo, indica que tiene una única temperatura en un momento determinado. Si además la temperatura se conserva constante durante un periodo de tiempo determinado, se debe indicar.
Proceso adiabático
Es el que se produce sin intercambio de calor con el exterior del sistema. En consecuencia, los sistemas aislados son adiabáticos.
Primera Ley de la Termodinámica
La Primera Ley de la Termodinámica relaciona el calor, Q, transferido al sistema, el trabajo, W, realizado por éste y los cambios ocurridos en la energía interna, U, del sistema; matemáticamente puede ser expresada así:
También conocida como Principio de Conservación de la Energía, viene a decir que “la energía no se consume” y que todo lo más que puede hacerse con ella es transformarla”. El proceso de transferencia puede ser de naturaleza mecánica, eléctrica o de cualquier otra forma y tendrá signo negativo cuando sea realizado sobre el sistema.
Un sencillo ejemplo puede servir para aclarar el concepto, considerando un recinto perfectamente aislado (adiabático) que es calentado mediante un calefactor eléctrico. Como resultado del trabajo eléctrico![]() , aumenta la energía del sistema. Como el sistema es adiabático no tiene ninguna interacción térmica con los alrededores, Q = 0, por tanto el principio de conservación de la energía indica que se ha producido un aumento de la energía del sistema por aporte eléctrico procedente del exterior.
, aumenta la energía del sistema. Como el sistema es adiabático no tiene ninguna interacción térmica con los alrededores, Q = 0, por tanto el principio de conservación de la energía indica que se ha producido un aumento de la energía del sistema por aporte eléctrico procedente del exterior.
Otro ejemplo, al accionar el pistón de un cilindro se comprime el aire contenido en su interior, produciéndose un aumento de su temperatura. Ello se debe a que la mayor parte del trabajo realizado al mover el pistón, es transformado en energía calorífica.
Una consecuencia importantísima de la Primera Ley de la Termodinámica, es que en cualquier proceso cíclico, los estados inicial y final son idénticos y por lo tanto se puede escribir que Q – W = 0.
Segunda Ley de la Termodinámica
La Segunda Ley de la Termodinámica tiene que ver con la dirección de los procesos y con la calidad de la energía. Antes de exponer su enunciado, conviene realizar algunas reflexiones.
Es bien conocido el fenómeno por el que la taza de café se enfría al cabo de un tiempo, debido a que parte de su energía térmica es trasferida al aire ambiente que la rodea. Sin embargo no se da jamás el proceso inverso, por mucho tiempo que pase el café en la taza, no se calienta.
Una estufa calienta la masa de aire de una habitación al ser alimentada por la corriente eléctrica. Pero si en la misma habitación se insufla aire caliente, jamás se conseguirá generar electricidad en la estufa.
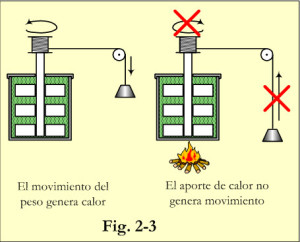 Si en un calorímetro, ver fig. 2-3, se colocan unas aspas accionadas por la caída de un peso, se calienta el fluido contenido en el calorímetro. Pero si se calienta el fluido del calorímetro con una fuente de calor, el peso no asciende. Al frotar las manos entre si se calientan, pero no es posible conseguir que se froten al calentarlas.
Si en un calorímetro, ver fig. 2-3, se colocan unas aspas accionadas por la caída de un peso, se calienta el fluido contenido en el calorímetro. Pero si se calienta el fluido del calorímetro con una fuente de calor, el peso no asciende. Al frotar las manos entre si se calientan, pero no es posible conseguir que se froten al calentarlas.
De todo ello se desprende que los procesos se realizan en cierta dirección, pero no en la dirección inversa.
Existen dos formas distintas de enunciar la segunda ley de la termodinámica. El enunciado de Kelvin-Planck relativo a las máquinas térmicas que dice:
Es imposible para cualquier dispositivo que opera en un ciclo, recibir calor de un solo depósito y producir una cantidad neta de trabajo.
Es decir, toda máquina térmica debe poseer una fuente (alta temperatura) y un sumidero de calor (baja temperatura). Una consecuencia de esta ley es que no existe ninguna máquina térmica con una eficiencia del 100%.
Por su parte Clausius en relación con refrigeradores o bombas de calor lo enunció así:
Es imposible construir un dispositivo que opere en un ciclo y cuyo único efecto sea producir la transferencia de calor de un cuerpo a una temperatura cualquiera, a otro que se halla a temperatura superior.
Es sabido que el calor no fluye por si solo del cuerpo frío al caliente, es necesario aportar un trabajo, tal como hace el compresor en los refrigeradores.
Ambos enunciados son equivalentes en sus consecuencias, cualquier dispositivo que viole el enunciado de Kelvin-Planck viola también el de Clausius y viceversa.
Obsérvese que ambos enunciados son negativos y por ello no se pueden probar. Como otras leyes físicas, la Segunda Ley ha sido enunciada a partir de observaciones experimen-tales. Hasta el presente no se no se ha podido realizar ninguna prueba que contradiga ambas definiciones.
La Segunda Ley de la Termodinámica enfocada hacia la temperatura, puede enunciarse así:
El calor siempre fluye espontáneamente del foco caliente (temperatura superior) al foco frío (temperatura inferior), y no lo hace nunca a la inversa sin aporte de energía exterior.
Ello permite afirmar que el calor con alta temperatura es de más calidad que el de baja temperatura.
Proceso reversible
Proceso reversible es aquel que puede invertirse sin dejar huella en los alrededores. Es decir que tanto el sistema como los alrededores regresan a su estado inicial al finalizar el proceso inverso. Obviamente en este caso el intercambio de calor neto entre sistema y alrededores al realizar ambos procesos (original e invertido) será cero. Igualmente el intercambio de trabajo neto entre sistema y alrededores también será cero.
Proceso irreversible
Todo proceso que no es reversible se denomina irreversible. En un proceso irreversible el sistema es capaz de retornar a su estado inicial, pero los alrededores han realizado algún trabajo sobre el sistema y por lo tanto no pueden regresar a su estado inicial.
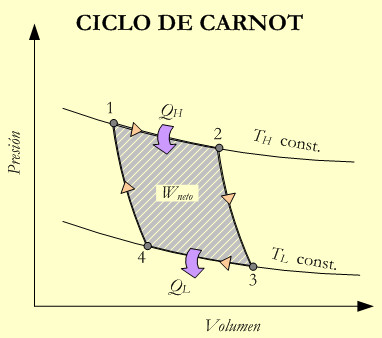
El ciclo de Carnot
Con la aparición de la máquina de vapor de James Watts en 1769, se inició la revolución industrial. Hasta ese momento las máquinas productoras de trabajo estaban basadas en el viento, las corrientes de agua o la fuerza animal. Pero la máquina de vapor demuestra la viabilidad de obtener un trabajo a partir de la energía calorífica.
Las máquinas térmicas son dispositivos cíclicos, en los que el fluido de trabajo regresa a su estado inicial después de cada ciclo. En una parte del ciclo, el fluido realiza un trabajo y en la otra parte el fluido absorbe un trabajo, de modo que la diferencia entre ambos da como resultado el trabajo neto entregado por la máquina. Cuanto mayor sea el trabajo entregado y menor el consumido, mejor será el rendimiento de la máquina.
Con el fin de disponer de un método para evaluar la bondad de las máquinas térmicas, el ingeniero francés Sadi Carnot propuso en 1824 una máquina virtual, capaz de proporcionar el máximo rendimiento y así poder evaluar cualquier máquina térmica real por comparación con esta máquina virtual. El rendimiento de cualquier máquina térmica vendrá dado por la expresión:
donde Q es el calor consumido por la máquina para realizar un trabajo W. En el diseño de su máquina virtual, Carnot estableció las siguientes características:
- Existencia de una fuente y un sumidero de calor cuyas temperaturas determinarán la cantidad de trabajo que la máquina podrá realizar. Con ello, implícitamente se reconoce la necesidad de que la máquina trabaje entre dos focos de calor a diferentes temperaturas para que puede ser termodinámicamente eficiente.
- Utilización de un ciclo de trabajo constituido por procesos reversibles, dado que estos son los que presentan mayor rendimiento.
- Total ausencia de pérdidas mecánicas o caloríficas.
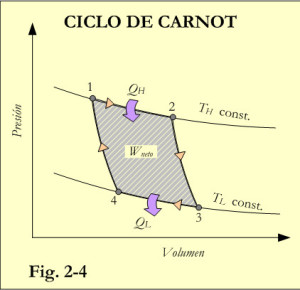
Como se indica en la figura 2-4 el ciclo de Carnot tiene un punto de partida (1) caracterizado por un fluido en unas condiciones de presión y volumen y cuyos cuatro procesos son los siguientes:
Expansión isotérmica reversible (1-2) realizada a la temperatura TH de la fuente de calor. Es decir, se produce un aporte de energía térmica QH al fluido de proceso (gas ideal), que da como resultado un inicio de expansión en el gas. Esta expansión infinitesimal provoca una reducción de temperatura, también infinitesimal, que es compensada por el aporte calorífico del foco de calor que repone la temperatura del gas a TH. De modo que durante todo el proceso (1-2) la temperatura se mantiene constante.
Expansión adiabática reversible (2-3) durante este proceso, no se produce aporte de calor (ni pérdidas al exterior), por su naturaleza adiabática. Durante este proceso el gas se expande y se enfría, pasando de la temperatura TH a la TL.
Como consecuencia de la expansión del gas la máquina realiza un trabajo. Como se supone que no hay pérdidas por rozamiento, el proceso es también reversible.
Compresión isotérmica reversible (3-4) estableciéndose contacto con el sumidero de calor que se encuentra a la temperatura TL. Se comprime el gas mediante una fuerza externa, cuyo trabajo sobre el gas produce una reducción del volumen y un aumento de la presión. Los incrementos de temperatura infinitesimales producidos por los correspondientes aumentos de presión, son inmediatamente absorbidos por el sumidero de calor, de modo que durante todo el proceso la temperatura se mantiene constante (isotérmica) en un valor TL. La cantidad de calor evacuada al sumidero será QL.
Compresión adiabática reversible (4-1) tiene lugar con la máquina aislada del sumidero y sin pérdidas de calor al exterior. Por tratarse de un proceso adiabático, es decir sin intercambio de calor, el trabajo aplicado sobre el gas para reducir su volumen hasta alcanzar el de las condiciones iniciales, provoca un aumento de la temperatura desde TL hasta TH. Completándose el ciclo.
El diagrama P,V de la figura 2-4 muestra el ciclo de trabajo de la máquina de Carnot y los diferentes trabajos, consumido y realizado. El área encerrada dentro del ciclo corresponde al trabajo neto, W. Para ello se ha debido aportar una cantidad de energía térmica que viene dada por el balance QH– QL. Así pues, aplicando la primera ley de la termodinámica resulta que: W=QH– QL
Como todos los procesos utilizados son reversibles, el cambio de entropía en cada ciclo será nulo, de modo que puede escribirse:
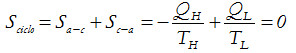 es decir que,
es decir que, 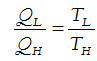
Como el rendimiento de una máquina térmica es la relación entre trabajo entregado y calor aportado y además, el máximo rendimiento posible es 1, obtendremos que:
Conclusiones del Ciclo de Carnot
De la expresión del rendimiento de una máquina térmica trabajando según el Ciclo de Carnot se desprende que:
Cuanto mayor sea la diferencia de temperatura entre la fuente y el sumidero de calor, mejor será el rendimiento de la máquina. Es decir que, para una misma fuente de energía térmica, cuanto menor sea la temperatura del sumidero, TL, mayor será el rendimiento.
El menor valor posible de TL es cero. Puesto que para valores más pequeños, una temperatura negativa, daría como resultado rendimientos superiores a la unidad. Es decir que estaríamos ante una máquina térmica capaz de realizar trabajo sin aporte de energía térmica, dicho en otras palabras, sería una máquina de movimiento perpetuo.
La existencia de un límite inferior de temperatura termodinámica, cuyo valor es de cero, sirvió a William Thompson, (Lord Kelvin, 1824-1907) para proponer en 1851 las bases de una nueva escala de temperatura termodinámica absoluta.
La Escala Termodinámica de Temperatura
James Prescott Joule (1818-1889) elaboró en 1847 un tratado exponiendo sus precisas investigaciones sobre la equivalencia del trabajo en calor. En él se evaluaba cuidadosamente el incremento de temperatura producido en el agua por el trabajo realizado al mover unas paletas dentro de un calorímetro.
Más tarde, Lord Kelvin en 1851, presentó un estudio que continuando los trabajos de Joule profundizaba en las leyes de la Termodinámica. Uno de cuyos resultados fue la propuesta de una Escala Termodinámica de Temperatura Absoluta, basada en las propiedades de la energía y no en las características de los materiales o sistemas de medida, como se venía haciendo hasta ese momento.
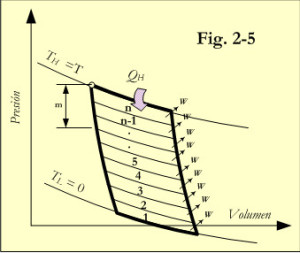
En su estudio, Kelvin sugirió, que cualquier temperatura T podía ser medida por medio del trabajo desarrollado por una máquina térmica de Carnot, cuyo ciclo estuviera comprendido entre T y el cero absoluto. Ver figura 2-5. Ese ciclo podría ser descompuesto en n ciclos unitarios, de modo que, el número de ciclos elementales fuese el valor absoluto de la temperatura.
En este punto conviene recordar que:
El Segundo Principio de la Termodinámica afirma que la energía tiene calidad. Además indica que los procesos térmicos naturales tienen una dirección, desde el foco o depósito fuente (más caliente) al sumidero de calor (menos caliente). El calor de ambos es caracterizado por la temperatura termodinámica.
Las máquinas térmicas son dispositivos cíclicos que convierten la diferencia de calor existente entre dos depósitos a diferente temperatura (fuente y sumidero) en un trabajo. El ciclo de Carnot es el desarrollado por una máquina térmica reversible (ideal) y por tanto con el mayor rendimiento absoluto posible, cuyo valor viene determinado por la expresión:
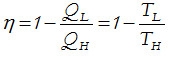
de todo ello se deduce que
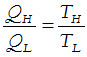
La temperatura termodinámica del sumidero ha de ser TL ≥ 0. Es decir, no puede existir ninguna temperatura absoluta inferior a cero, pues ello daría como resultado que η > 1. Lo que significaría la existencia de la máquina de movimiento perpetuo (produce más cantidad de trabajo, que la energía absorbida)
Por estar situado el ciclo total entre dos isotermas a temperaturas T y 0, el calor cedido QL valdría cero, mientras que el absorbido sería QH= nW. Cada ciclo elemental entregaría la misma cantidad de trabajo, W. De esa manera los incrementos de trabajo iguales forman una escala, donde únicamente es necesario determinar el tamaño del incremento W. Numerando las isotermas de cada ciclo elemental de Carnot comenzando por abajo, desde cero a τ, se obtiene una escala de temperaturas termodinámicas de 0 a τ. Seleccionando un grupo de m ciclos en la parte superior (de arriba abajo), el calor evacuado en la parte inferior de los m ciclos será Q-mW, siendo Q la energía tomada por la parte superior del ciclo. Puesto que todo el calor Q se convierte en trabajo si se utilizan los n ciclos y no se cede ningún calor en el último ciclo, Q = nW. Entonces la eficiencia para los m de ciclos superiores es:
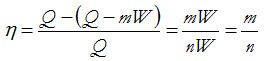
y habiendo definido la nueva temperatura termodinámica igual al valor del número de ciclos, τ =n queda
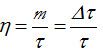
donde τ representa la temperatura en la escala Kelvin y Δτ representa m. Sin embargo para un Ciclo de Carnot se cumple que η = ΔT/T, entonces:
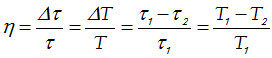
o 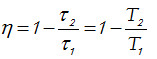
para cualesquiera estados 1 y 2. Por lo tanto,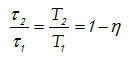
Esto es cierto para cualquier par de temperaturas T1 y T2. Pero solo es posible únicamente si τ = CT, donde C es un constante. Y escogiendo W de forma que, τ = T y C=1, no se necesita τ, sino únicamente T. Se obtiene así una escala que funciona termodinámicamente, o lo que es igual, está basada en energía. La escala absoluta de los gases perfectos igual que la escala termodinámica Kelvin, son escalas termodinámicas.
Para ajustar el grado absoluto con el grado Celsius, Kelvin proporcionó dos alternativas: Una consistente en, establecer un punto fijo “A” preciso y elegir el tamaño del grado de la escala termodinámica y el de la escala práctica de manera que tengan el mismo valor. Esta escala utiliza el cero absoluto como segundo punto fijo, de forma que entre los dos puntos se establece una línea recta (que obviamente, pasa por cero). La otra alternativa seleccionaba dos puntos de la escala práctica, haciendo pasar por ellos a la escala termodinámica, eligiendo el tamaño del grado de forma que la temperatura de ambas escalas fuese numéricamente igual. Esta última alternativa fue la elegida como el método más práctico en aquel momento (1854), sin embargo Kelvin prefería la primera.
Lord Kelvin no ignoraba las dificultades para la realización práctica de la escala, de los diversos termómetros existentes solo los de gas podrían dar los mejores resultados, (aunque proporcionaban ciertas diferencias de temperatura para la misma isoterma) de modo que propuso su empleo como la mejor aproximación práctica a la escala de temperatura termodinámica. El termómetro de gas ha venido siendo utilizado con este fin desde hace tiempo.
Termómetro de gas
La medida termodinámica de la temperatura esta basada en la ley de los gases perfectos
P x V=n x R x T [2.1]
Por lo tanto la temperatura absoluta o termodinámica, puede expresarse como:
donde n es el numero de moles contenido en el gas y R es la constante universal de los gases perfectos. Es decir que la temperatura de un volumen de gas puede ser calculada a partir de la presión, P y el volumen V. Pero esta expresión solo es cierta para los gases perfectos, que como sugiere la palabra son inexistentes en condiciones más o menos normales. Sin embargo se sabe que los gases monoatómicos y en particular Helio e Hidrógeno se comportan de forma bastante aproximada como gases perfectos.
La fórmula [2.2] permite determinar la temperatura por dos métodos diferentes:
- Con volumen de gas constante, medir la variación de presión
- Con presión de gas constante medir la variación de volumen
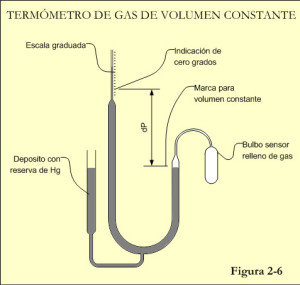
Es más fácil medir presiones que volúmenes y por ello es más utilizado el termómetro de volumen constante. La figura 2-6 presenta una versión simplificada de este artefacto, que esta formado por tres componentes principales:
- Bulbo de medida
- Manómetro en U
- Depósito compensador
El Bulbo sensor es un recipiente, generalmente de vidrio, lleno de un gas, que suele ser Helio, cuya presión varía con la temperatura.
El Manómetro en U está conectado al bulbo sensor por medio de un fino tubo. Es el elemento medidor de la presión del gas contenido en el bulbo sensor.
El Depósito compensador está conectado a los otros dos componentes, para añadir o retirar parte del fluido de medida del manómetro en U. Para ello dispone de un pistón de accionamiento manual. El objeto de este dispositivo es conservar constante el punto de 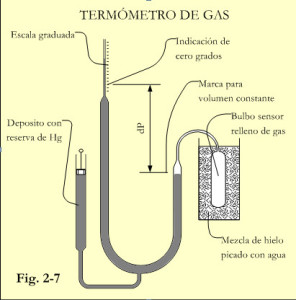
interfase entre el gas sensor y el fluido medidor del tubo en U, conservando constante el volumen de gas.
Para establecer una escala de medida, hay que determinar dos puntos sobre la columna de medida del manómetro en U. Al principio estos puntos eran los determinados por la congelación (o fusión del hielo) y la ebullición del agua. Ver figura 2-7.
Sumergiendo el bulbo sensor en un baño termostático que contiene una mezcla bien homogénea de agua y picadura de hielo, se obtiene la primera indicación de presión que corresponde a una temperatura de 0ºC. El punto de contacto entre gas y fluido barométrico (p.e. Hg) deberá estar perfectamente marcado, pues deberá mantenerse constante en cada medición de temperatura.
Para la determinación del segundo punto, se sumergirá el bulbo sensor en un baño termostático con agua en ebullición (a una presión de 1 atmósfera, o 101.325 Pa). Como consecuencia del incremento de temperatura, el gas aumenta su presión y volumen. Actuando sobre el pistón del depósito compensador se recuperará la posición que tenía en la anterior medición la interfase gas-fluido. En estas condiciones de volumen constante, la presión indicada en el tubo en U corresponderá a la temperatura de 100ºC. Una vez determinados estos dos puntos correspondientes a 0 y 100ºC, se puede construir la escala de temperatura deseada, para valores comprendidos entre estos puntos se realizará la interpolación necesaria.
La presión a 100ºC es 1,366099 veces mayor que la correspondiente a 0ºC de modo que se puede calcular:
De donde se deduce que un grado Celsius es el 1/273,15 de la variación de presión provocada por un cambio de temperatura de 0 a 100ºC. Por tanto la menor temperatura posible será -273,15ºC. A esta temperatura la presión será P = 0 que según la ecuación de los gases perfectos corresponderá a una temperatura absoluta de T = 0 K.
Las mediciones de los termómetros de gas a volumen constante pueden ser expresadas por la ecuación:
donde Tn son temperaturas en Kelvin y T0 es el origen de esta escala. Esta relación es exacta para un gas perfecto y por tanto satisface la ley de Charles [2.1], en la cual el valor de la constante de los gases perfectos vale R = 0,082053 con una incertidumbre de unos 30 ppm. También ha de satisfacer la condición de que no existan fuerzas intermoleculares actuando.
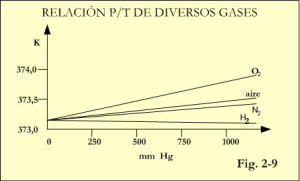
Como no se dispone de un gas ideal y además 30 ppm es un valor no despreciable, las mediciones con He y CO2, aún siendo las más cercanas presentan una gran incertidumbre. Sin embargo hay que señalar que los gases reales, presentan un comportamiento cada vez más similar a los gases perfectos a medida que se reduce la presión; ver figura 2-9.
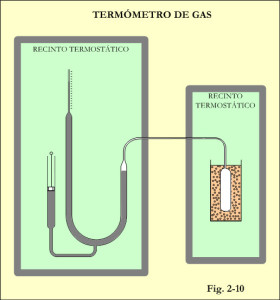
Para que el termómetro de la figura 2-6 responda de la mejor forma posible, todo el conjunto ha de ser alojado dentro de un recinto protector de las variaciones de temperatura ambiental que pueden influir sobre la medición de presión y el ajuste de volumen. Pero como el bulbo sensor se ha de manipular fácilmente para sumergirlo en los diferentes medios y temperaturas, se recurre a disponer de dos recintos termostatados, uno para el sensor y otro para el sistema de medición tal como se aprecia en la figura 2-10. El inconveniente es que hay un tramo de tubo situado entre ambos recintos sometido a una temperatura incontrolada, cuya influencia sobre la medición ha de ser tenida en cuenta. Una forma de reducir el error de medición será la de minimizar el volumen del tubo con relación al volumen total. Ello implica el uso de tubo capilar de la menor sección posible, aunque no tan delgado que de lugar a la aparición de presiones intermoleculares cuando el tubo pasa por zonas de diferente gradiente de temperatura. Algunos fabricantes colocan varios sensores a lo largo del tubo con el fin de realizar las correcciones necesarias. Al tiempo se procura ampliar el tamaño del bulbo.
También ha de tenerse en cuenta la expansión térmica de los materiales empleados con el fin de realizar la corrección oportuna. Otro factor a considerar es la altura hidrostática de la columna de gas en el bulbo, que puede modificar su comportamiento, para evitarlo el bulbo se coloca en posición horizontal.
Las impurezas existentes en el gas también han de ser contempladas, de modo que el resultado de la medición deberá ser corregido, so pena de incurrir en errores del orden de 20 a 30 mK.
Resumiendo, la termometría de gas por su complicado manejo y elevada incertidumbre es muy poco apta para realizar mediciones industriales, quedando su uso limitado a laboratorios de patrones.
Final
La segunda preferencia de Kelvin, basada en el empleo de dos puntos fijos por los cuales se hace pasar la escala termodinámica, ha sido utilizada hasta 1954. Los dos puntos fijos eran el punto de congelación y el punto de vaporización del agua. Esta escala fue extrapolada para establecer el cero absoluto. El termómetro de hidrógeno a baja presión fue utilizado para aproximar la escala termodinámica. En 1954 se eligió el triple punto del agua como único punto fijo, además del cero absoluto, de acuerdo con la primera preferencia de Lord Kelvin. La escala práctica ha sido revisada varias veces, (cada 20 años aproximadamente) en función de la disposición de mejores equipos de medida y por tanto de mayores aproximaciones a la escala termodinámica. Actualmente la conformidad entre ambas escalas es de fracciones de grado, en todo el campo de medición más común. Más adelante se analizará la Escala Internacional de Temperatura, ITS-90, que es como se denomina a la actual escala práctica de medición de temperatura.



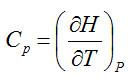
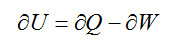
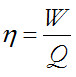
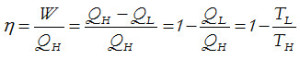
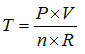
Sorry, the comment form is closed at this time.